Chronická myeloidní leukemie
(přesměrováno z CML)
| Chronická myeloidní leukemie | |
| C92.1 | |
| 9863/3 | |
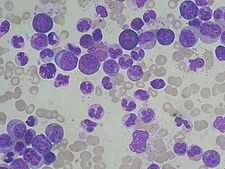 Převaha elementů granulopoezy | |
| Lokalizace | kostní dřeň |
|---|---|
| Prevalence v ČR | zvyšující se kvůli cílené terapii |
| Incidence v ČR | 1,2/100 000 |
| Maximum výskytu | 60-65 |
| Klíčová mutace | (9;22)(q3.4;q1.1) Philadelphský chromozom |
| Terapeutické modality | chemoterapie, biologická léčba |
Chronická myeloidní leukemie (CML) je maligní klonální onemocnění hematopoézy, charakterizováno přítomností specifické získané genetické abnormality – Philadelphského chromozomu (Ph-chromozomu), který vzniká translokací t(9;22). Tato translokace způsobí nekontrolované množení krvetvorných buněk myeloidní linie, především se projeví leukocytóza. Představuje asi 15-20 % nově zjištěných leukemií, incidence v ČR je 1,2/100 000 obyvatel ročně. Medián diagnózy se pohybuje kolem 60–65 let, u dětí je výskyt vzácný.
Příčiny[upravit | editovat zdroj]
CML je způsobena reciprokou translokací částí dlouhých ramének mezi chromozomy 9 a 22. Na takto vzniklém Philadelphském chromozomu, se nachází fúzní gen BCR-ABL1. Tento gen produkuje patologickou, konstitutivně aktivovanou tyrosinkinázu Bcr-Abl, která je zodpovědná za nekontrolované množení krvetvorných buněk a jejich sníženou odpověď na proapoptotické signály. Samotná příčina vzniku Philadelphského chromozomu není známa.
Projevy[upravit | editovat zdroj]
Onemocnění je charakterizováno 3 fázemi: chronickou (CF, 95% diagnóz), akcelerovanou (AF) a blastickou (BF). Intenzita symptomů většinou narůstá s pokročilostí fáze. Samotné symptomy jsou nespecifické:
- únava, zvýšené pocení, hmotnostní úbytek
- subfebrilie až febrilie
- bolesti v levém podžebří, pocit plnosti po jídle
- splenomegalie, případně hepatomegalie
- vzácně krvácení a projevy leukostázy (dušnost, priapizmus)
Syndrom leukostázy[upravit | editovat zdroj]
Hyperleukocytóza je hodnota leukocytů vyšší než 100 000/μl. U pacientů s CML se příznaky leukostázy projevují až při hodnotách okolo 400 000/μl. Vysoký počet leukocytů vede ke zvýšení viskozity krve, obstrukci kapilár a následné hypoxii nebo krvácení při jejich ruptuře. To se projeví rozličnými neurologickými příznaky, poruchou zraku při hemoragii do sítnice, dušností, ischemií jiných orgánu nebo priapismem. U pacientů s hyperleukocytózou a projevy leukostázy provádíme leukaferézu a cytoredukci (hydroxyurea) s cílem předejít nebo zmírnit tyto příznaky a komplikace. V úvodu je nutná dostatečná hydratace.
Kolem 50 % pacientů bývá asymptomatických a choroba bývá zjištěna náhodně.
Diagnostika[upravit | editovat zdroj]
V krevním obraze typicky leukocytóza s posunem doleva v neutrofilech, střední vývojové formy granulocytů (myelocyty, metamyelocyty) eosinofilie, bazofilie. Často trombocytémie, vzácněji trombocytopenie, polyglobulie či anemie. Při akcelerované a blastické fázi bývají v periforní krvi i myeloidní blasty podobně jako u akutní myeloidní leukemie.
Cytogenetické vyšetření aspirátu kostní dřeně prokáže přítomnost Ph-chromozomu, fluorescenční in situ hybridizace prokáže přítomnost genu BCR-ABL1, RT-PCR potvrdí pozitivitu transkriptu BCR-ABL1.
Chronická fáze:
- nesplňuje kritéria akcelerované ani blastické fáze
Akcelerovaná fáze musí splňovat jedno nebo více z následujících kritérií:
- 10–19 % blastů v krvi nebo dřeni
- ≧20 % bazofilů v krvi
- perzistující trombocytopenie (nezpůsobená léčbou) nebo nereagující trombocytóza
- narůstající počet leukocytů a zvětšující se slezina
- klonální evoluce
Blastická fáze musí splňovat jedno nebo více z následujících kritérií:
- ≧20 % blastů v krvi nebo dřeni
- extremedulární blastická proliferace
Po stanovení diagnózy je vhodné biochemické vyšetření funkce jater, pankreatu a ledvin, lipidového profilu, glykemie, mineralogramu, EKG, echokardiografie a stanovení velikosti sleziny pro výběr vhodného léčiva a výpočet prognostického skóre.
Prognostické skóre (ELTS) pro pacienty v chronické fázi nutno vypočítat před zahájením terapie z věku, velikosti sleziny, množství bazofilů, eozinofilů, blastů a trombocytů v krvi.
European Leukemia Net: The EUTOS long-term survival (ELTS) score
Léčba[upravit | editovat zdroj]
Základem léčby CML jsou inhibitory tyrosinkináz (TKI). Cílem je dosáhnout hluboké molekulární odpovědi, definované jako pokles hladiny transkriptu BCR-ABL1 o 4–5 logaritmů vůči standardizované hladině.
Léčbou první linie je jeden buď TKI 1. generace imatinib, nebo některý z TKI 2. generace – nilotinib, dasatinib nebo bosutinib. Výběr konkrétního TKI záleží na rizikovosti CML a komorbiditách pacienta. Přítomnost mutace T315I v ABL kinázové doméně je indikací k použití TKI 3. generace ponatinibu. Každý z dostupných TKI má účinnost na jiné spektrum mutací ABL kinázové domény a jiné nežádoucí účinky. Proto je vždy nutno vybrat nejvhodnější preparát pro konkrétního pacienta a v konkrétní fázi onemocnění.
Léčba druhé linie, v případě rozvoje rezistence na daný TKI nebo progrese onemocnění, spočívá v nasazení jiného vhodného TKI, nejlépe po analýze mutací ABL kinázové domény.
Po selhání druhé linie lze u nízko a středně rizikových pacientů podat třetí TKI, u vysoce rizikových je indikována transplantace krvetvorných kmenových buněk. Pokud není možné provést transplantaci, podává se interferon–alfa.
U pacientů diagnostikovaných v akcelerované a blastické fázi je podán TKI (většinou 2. nebo 3. generace). V případě nedosažení optimální odpovědi, nebo pokud dojde k posunu do AF/BF počas léčby, je indikována transplantace krvetvorných kmenových buněk. AF a BF může být přitom myeloidní (častěji) nebo lymfoidní podle diferenciace blastů. Při rychlém průběhu a vysokém počtu blastů se před provedením transplantace podává některý z intenzivních záchranných chemoterapeutických režimů podobně jako o akutní myeloidní nebo lymfoblastické leukemie (FLAG, FLAG-IDA, HyperCVAD...).
Paliativní cytoredukce hydroxyureou je podávána u pacientů s vyčerpanými veškerými léčebnými možnostmi. Tato situace již dnes nastává zřídka.
Léčebný efekt se monitoruje pomocí krevního obrazu, cytogenetického vyšetření v 3., 6. a 12. měsíci a RT-PCR každé 3 měsíce. U pacientů v dlouhodobé hluboké molekulární remisi bez předchozího selhání léčby lze zvážit postupné vysazení TKI za bedlivé monitorace stavu choroby. Vysazení TKI a jeho podmínky jsou aktuálně předmětem klinických studií a diskuzí odborníků.
Diferenciální diagnostika[upravit | editovat zdroj]
Diagnóza CML je vymezena typickým nálezem v krevním obraze a kostní dřeni, přítomností Ph-chromozomu a fúzního genu BCR-ABL1. Podobný klinický obraz mohou mít:
- Ph-negativní myeloproliferativní onemocnění (polycytemia vera, esenciální trombocytopenie, primární myelofibróza, vzácně Ph-negativní atypická CML)
- chronická myelomonocytární leukemie
- akutní leukemie (může být těžké rozlišit de novo CML v lymfoblastické fázi a BCR-ABL1-pozitivní ALL)
- leukemoidní reakce (např. při infekci)
Prognóza[upravit | editovat zdroj]
U pacientů s CML zjištěnou v CP se u optimální léčebné odpovědi dlouhodobé přežití téměř neliší od zdravé populace. V AP je 6–8leté přežití mezi 60 a 80 %. V blastické fázi zůstává prognóza nepříznivá, medián přežití se pohybuje mezi 6 a 24 měsíci.
Odkazy[upravit | editovat zdroj]
Související články[upravit | editovat zdroj]
- Chronická lymfocytární leukemie
- Akutní myeloidní leukemie
- Akutní lymfoblastická leukemie
- Leukemie z vláskových buněk
- Philadelphský chromozom
- Imatinib
Reference[upravit | editovat zdroj]
- BÜCHLER, Tomáš. Speciální onkologie. 2. vydání. Praha: Maxdorf, [2020]. Jessenius. ISBN 978-80-7345-651-1.
- DOUBEK, Michael, MAYER, Jiří (Eds.). Léčebné postupy v hematologii 2020. Doporučení České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně. 1. vyd. 2020. ISBN 978-80-270-8240-7.
- Chronic Myeloid Leukemia in 2020
- European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia

